准静态过程
热力学过程:系统从一个平衡态过渡到另一个平衡态所经过的历程。
弛豫时间:旧平衡态破坏到新平衡态建立所需的时间。
准静态过程:如果热力学系统经历某一过程该过程进行得足够缓慢,且系统连续经过的每个中间态都可近似地视为平衡态,即过程经历的时间大于弛豫时间,则该过程为准静态过程。
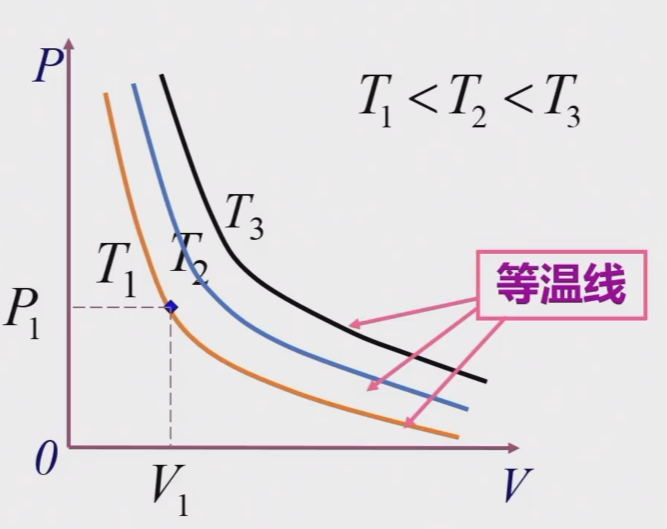
由于状态图上每一点都是平衡态,准静态过程可用P−V图中的一条曲线来表示。
热力学第一定律
改变热力学系统的状态可通过做功和传热,其结果使系统内能发生变化。
热力学第一定律:
Q=E2−E1+W=ΔE+W
- Q:从外界吸热
- W:系统对外做功
- E:系统的内能
如果初、末两态无限接近,即过程为一无限小过程,则热力学第一定律可表述为:
dQ=dE+dW
W,Q的正负约定
- 系统对外界做功W>0,系统从外界吸热Q>0
- 外界对系统做功W<0,系统向外界放热Q<0
功的计算
系统对外界做元功为
dW=Fdl=pSdl=pdV
V是系统的体积
若系统的体积由V1变为V2,则对外界做功
W=∫V1V2pdV
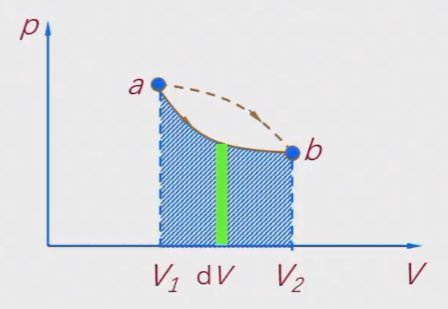
比较ab两种路径下的面积可知,功的数值不仅与初态和末态有关,而且还依赖于所经历的中间状态,功与过程的路劲有关,功是过程量。由于内能是态函数,从第一定律可知,热量也是过程量
Q=ΔE+W
理想气体的等体过程和等压过程
一个系统温度升高dT时,如果它吸收的热量为dQ,则系统的热容量定义为
C=dQ/dT
比热c=C/M,摩尔热容Cm=C/v
因热量与过程有关,故同一系统,在不同过程中的热容量有不同的值。有实际意义的是使热传递过程在一定条件下进行,因而对应不同过程就有常用的定体热容量与定压热容量。
等体过程 定体摩尔热容
等体过程中dV=0,有
Qr=ΔE=v2iRΔT
系统吸收的热量全部转变为内能的增量。
定体摩尔热容为1mol物质在体积保持不变,温度升高1K所吸收的热量
CV=vdTdQV
对于理想气体dQV=v2iRdT,则
CV=2iR
理想气体的定体摩尔热容仅与分子的自由度有关。
等体过程吸收的热量dQV可表示为
dQV=dE=vCVdTQV=ΔE=∫T1T2vCVdT
由于内能仅为温度的函数,因而不论什么过程,只要温度的增量为dT,内能的增量一定为
dE=vCVdT
等压过程
等压过程dp=0,功dW=pdV=vRdT,内能dE=vCVdT,有热量
dQ=dE+dW=v(CV+R)dT
定压摩尔热容为1mol物质在压强保持不变,温度升高1K所吸收的热量
Cp=vdTdQ
对于理想气体,有
Cp=vdTv(CV+R)dT=CV+R=2i+2R
1mol理想气体温度同样升高1K,等压过程将比等体过程多吸收8.31J的热量
理想气体的等温过程和绝热过程
等温过程
dT=0,过程方程pV=常量,故内能ΔE=0,功与热量QT=W
气体从外界吸收热量全部用来对外做功。等温过程的摩尔热容为无限大。
从a到b,吸收热量和对外做功为
QT=W=∫V1V2pdV=∫V1V2VvRTdV=vRTlnV1V2
同样,还有vRTlnV1V2=vRTlnp2p1
绝热过程
系统与外界无热量交换,dQ=0
由热力学第一定律,有dE+dW=0
绝热膨胀过程,系统对外做功,是靠内能降低实现的,故温度降低;绝热压缩过程,外界对系统做功,全部转化为内能,故温度上升。
准静态过程中气体对外界所作的功为:dW=pdV
理想气体的内能:dE=vCVdT,式中CV为定体摩尔热容量。对绝热过程有vCVdT+pdV=0
对理想气体状态方程微分,可得:
vRdT=pdV+Vdp
两式联立,消去dT,得到
(CV+R)pdV+CVVdp=0⇓Vdp+γpdV=0⇒pdp+γVdV=0
其中γ=CVCp
两边积分,得过程方程
pVγ=c1
相似的还有
TVγ−1=c2pγ−1T−γ=c3
绝热过程dQ=0,因而摩尔热容为零。
等温线和绝热线的比较
等温方程:pV=cdVdp=−Vp
绝热方程:pVγ=cdVdp=−γVp
根据泊松公式,可以画出
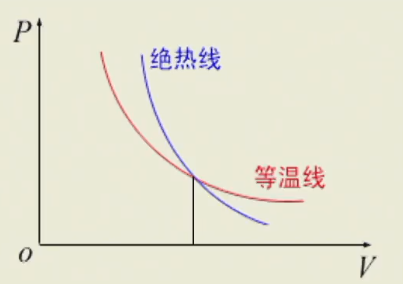
γ>1,故绝热线比等温线更陡。等温膨胀温度不变,绝热膨胀温度下降,由p=vRT/V可知,膨胀相同体积时,绝热过程压强降低更大。
绝热过程功的计算:借助第一定律
W=−ΔE=E1−E2=vCV(T1−T2)
利用泊松公式计算:
W=∫V1V2pdV=1−γ1[p2V2−p1V1]
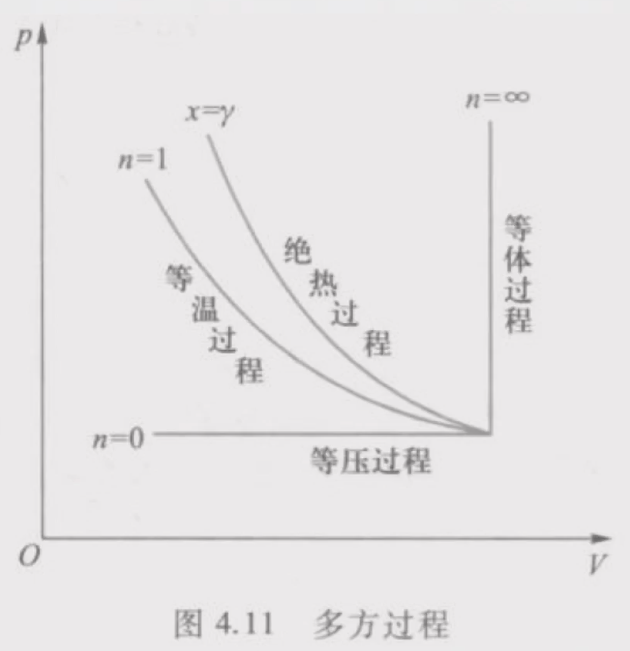
多方过程
实际上,气体所进行的过程,常常既不是等温,又不是绝热的,而是介于两者之间的,可表示为
pVn=常量
式中n为多方指数,凡满足上式的过程称为多方过程。
- n=1:等温过程
- n=γ:绝热过程
- n=0:等压过程
- n=∞:等容过程
多方过程的功:
W=∫V1V2pdV=∫V1V2Vnp1V1ndV=1−n1(p2V2−p1V1)
可以证明,多方过程的摩尔热容
Cn=n−1n−γCV
气体在多方过程中从外界吸收的热量:
Q=vCn(T2−T1)=(vCV−n−1vR)(T2−T1)
当1<n<γ时,Cn<0。说明气体在多方过程中对外界所做的功大于它从外界吸收的热量,多作的功是由于消耗了本身的内能,故虽然吸热,但温度反而下降,产生了负热容Q=ΔE+W




